La materia es todo lo que ocupa un lugar en el espacio y es capaz de adquirir formas muy diversas. El agua, el aire, las cosas, los seres vivos y todo lo que observamos en la naturaleza es materia.
Composición de la materia
Está compuesta por partículas invisibles que se llaman moléculas y que se dividen en otras más pequeñas llamadas átomos.
Aunque la palabra átomo significa “indivisible”, está fue utilizada porque se creía que era la mínima parte en la que se podía dividir la materia. Actualmente los científicos han descubierto que el átomo se divide en: electrones, protones y neutrones. Los electrones tienen carga negativa y giran en órbitas elípticas alrededor del núcleo, en donde se encuentran los protones que tienen carga positiva y los neutrones que no tienen carga eléctrica.
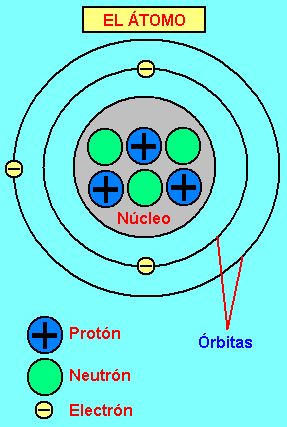
LOS ELEMENTOS
La materia compuesta de una sola clase de átomos recibe el nombre de ELEMENTO, actualmente se conocen 106 elementos, de los cuales 85 se han obtenido por fuentes naturales y los restantes por reacciones nucleares. Las características de sus átomos son: Poseen la misma cantidad de protones y electrones, el SÍMBOLO con el que se representan, el NÚMERO ATÓMICO que se refiere al número de electrones y la cantidad de neutrones que tienen en el núcleo. Se los encuentra clasificados en la TABLA PERÍODICA DE LOS ELEMENTOS, según el número atómico que determina su posición.
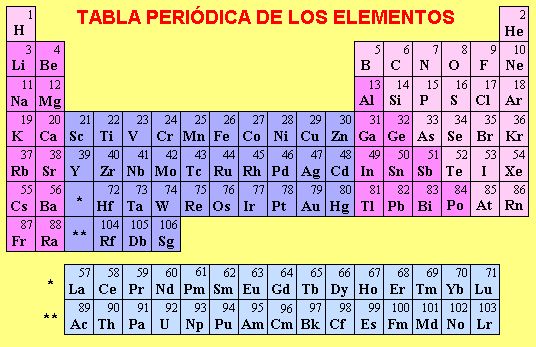
Los elementos según sus propiedades, se encuentran clasificados en la tabla periódica como: metales, semimetales y no metales; también muchos de ellos se encuentran clasificados como gases inertes.
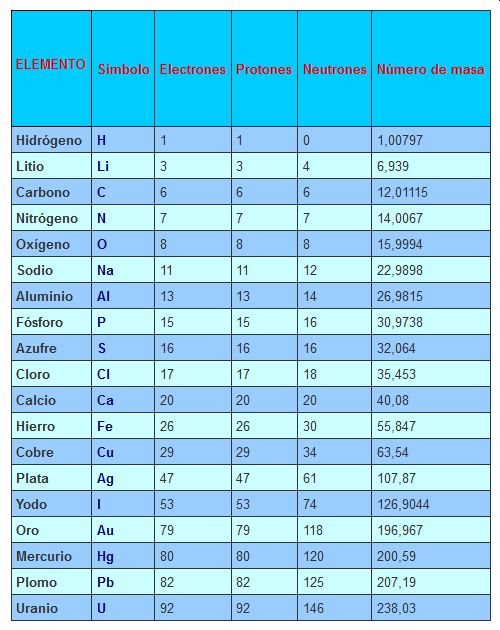
Número de masa de un átomo
Conocer la masa de un átomo es importante porque de éste depende su peso. Se sabe que la masa del electrón es 9,1096 x 10-28 g, la masa del protón es 1,6726 x 10-24 g (1836 veces la masa del electrón) y la masa del neutrón es muy similar a la del protón (1,6749 x 10-24 g), para simplificar los cálculos se definió la unidad de masa atómica unificada (u) que es 1/12 de la masa de un átomo de carbono 12C. De esta forma tenemos las masas de estas partículas expresadas así: 0.0005485803 u para el electrón, 1.007276 u para el protón y 1.008665 u para el neutrón. Como se puede apreciar la masa de los electrones es despreciable comparada con la de los protones y neutrones, por lo tanto la masa de un átomo se encuentra concentrada en su núcleo y como las masas de los protones y neutrones es aproximadamente 1, el cálculo de la masa de un átomo se obtiene fácilmente sumando el número de protones y neutrones. Ejemplo: El átomo de Sodio tiene una masa de 23 u (11 protones + 12 neutrones), verifique que en la tabla es 22,9898 el valor exacto.
LOS COMPUESTOS
Están formados por dos o más elementos en proporciones fijas, por lo tanto, están constituidos por átomos de diferentes clases. Ejemplo: El agua es un compuesto formado por los elementos hidrógeno y oxígeno, en la siguiente proporción: 11.19% de hidrógeno y 88.81% de oxígeno. Las moléculas de agua están formadas por dos átomos de hidrógeno y uno de oxígeno. Con esta información, conociendo que la masa de cada átomo de hidrógeno es 1 u, mientras que la de uno de oxígeno es 16 u, podemos fácilmente conocer que la masa de cada molécula de agua es 18 u. Aplicando una regla de tres simple sabemos que 18 u es el 100%, 2 u (Hidrógeno) corresponden al 11.11% y 2 u (Oxígeno) al 88.89%, que son aproximados a los reales que se indican arriba de este párrafo.
En la naturaleza existen más compuestos que elementos, porque existen varias combinaciones entre elementos, que forman los óxidos, ácidos, bases y sales.
Los óxidos se forman de la combinación del oxígeno con un metal, podemos apreciar la oxidación en algunas puertas metálicas o inclusive al comer una manzana, ya cuando la cortamos y la dejamos por algún tiempo, vemos que está cambia de color debido a la oxidación que se produce entre el oxígeno del ambiente y el hierro de la manzana, estos se conocen como óxidos metálicos u óxidos básicos; también se pueden formar óxidos de la combinación de un no metal con el oxígeno, estos se conocen como óxidos ácidos o anhídridos. Los óxidos básicos al combinarse con el agua forman las bases, mientras que los óxidos ácidos al combinarse con el agua forman los ácidos. Las sales son compuestos que resultan de la reacción de un ácido con una base.

Las bases son neutralizadoras de los ácidos y viceversa, las sustancias ácidas son agrias y las básicas son amargas, los ácidos vuelven azul el papel tornasol, mientras que las bases la vuelven de color rojo.
Muchos ácidos se encuentran en determinados alimentos como el ácido cítrico (naranjas, toronjas, limones) o que se utilizan como condimento como el caso del ácido acético (vinagre). Sin embargo hay otros venenosos como el ácido clorhídrico, ácido nítrico o el ácido sulfúrico, debido a que son sumamente fuertes capaces de destruir la piel y los tejidos del cuerpo. También existen bases muy fuertes como el hidróxido de sodio que se utiliza para destapar cañerías obstruidas o en la fabricación de jabones, el hidróxido de amonio empleado para limpiar cristales o muebles de madera. Sin embargo, hay otros como el hidróxido de aluminio que se utiliza para curar enfermedades estomacales, por su propiedad para neutralizar el efecto de los ácidos y aliviar así la acidez estomacal. El Ditopax Forte de Schering-Plough Corporation de Estados Unidos, contiene entre sus componentes Hidróxido de Aluminio e Hidróxido de Magnesio.

Hay elementos que tienden a combinarse rápidamente con otros para formar un compuesto, a estos se los denomina ELEMENTOS ACTIVOS, en cambio hay otros que se combinan muy lentamente o casi nunca se combinan, a estos se los conoce como ELEMENTOS PEREZOSOS, los elementos muy activos rara vez se los encuentra puros en la naturaleza. Ejemplo: El cloro es un elemento muy activo, mientras que el nitrógeno es un elemento poco activo. En cambio el Helio y los gases raros (argón, neón, xenón y kriptón) se llaman gases inertes, porque bajo condiciones normales no se combinan con ningún elemento.
COMBINACIÓN Y MEZCLA
Los compuestos pueden tener elementos combinados o mezclados. En una combinación química los elementos que las constituyen pierden sus propiedades y originan un compuesto diferente a ellos, en estas ocurre un cambio químico. En una mezcla, las sustancias reunidas conservan sus propiedades, simplemente, las partículas de unas sustancias se hayan junto a otras, en estas no ocurre un cambio químico.
La diferencia entre una combinación y una mezcla, hace que los elementos combinados solamente se puedan separar por procedimientos químicos, mientras que los elementos mezclados se pueden separar por procedimientos físicos.
La diferencia entre las combinaciones y las mezclas hacen que los compuestos se combinen en un determinado número, tal es el caso del agua cuya fórmula es H2O, pero si se altera la proporción de oxígeno (O) se podría obtener H2O2 que corresponde a la fórmula del agua oxigenada. En cambio en una mezcla de agua con azúcar se pueden alterar las cantidades de agua y azúcar, pero siempre se obtendrá agua azucarada. La mayor parte de la materia que existe en la naturaleza está constituida por mezclas, estas pueden ser de elementos o de compuestos, un ejemplo de mezcla de compuestos son las rocas.

Las sustancias mezcladas se pueden separar mediante procesos físicos. Por ejemplo: si tenemos una mezcla de limaduras de hierro, sal y arena, podemos utilizar un imán para separar el hierro de la arena, agua para disolver la sal en el agua y un lienzo para filtrar el agua y separar la arena. Así por procedimientos físicos tendríamos separado el hierro en el imán, la sal en el agua y la arena en el lienzo.
Fuente:
Revista Varitek Universal, Año 2 – Número 5, 15 de mayo del 2009.
